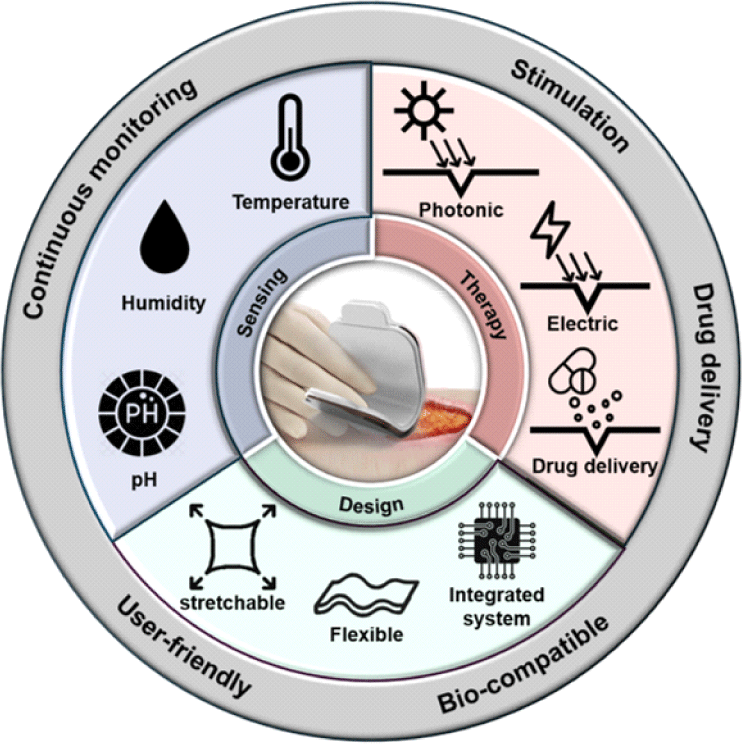
1. 서론
스마트 밴드(smart bandage)는 상처 치유 과정을 실시간으로 모니터링하고, 전기자극(electrical stimulation), 광자극(photobiomodulation), 약물 전달(drug delivery) 등의 치료 기능을 동시에 제공할 수 있는 지능형 드레싱(dressing) 시스템이다. 기존의 드레싱은 외부 자극으로부터 상처를 보호하고 체액을 흡수하는 수동적인(passive) 기능에 국한되었으며, 상처의 상태를 확인하기 위한 의료진의 주기적인 방문 혹은 드레싱 교체를 필요로 하였다. 이러한 관리 방법은 상처 상태를 실시간으로 확인하기 어렵고, 의료진의 업무 부담을 가중시켜 전반적인 의료 서비스의 질을 저하시킬 수 있다.
이러한 한계를 극복하기 위해 상처 부위의 생체 신호 감지 및 치료를 위한 밴드 시스템에 대한 연구가 활발히 진행되고 있다. 초기에는 상처 치유 과정 중 나타나는 생리적 변화를 감지하는 모니터링 센서와 물리적 자극을 가해 치유 속도 혹은 효율을 높이는 치료 시스템이 분리된 형태로 개발되었으나, 최근에는 생체 신호 센서, 치료용 자극 소자, 약물 전달 시스템 등이 통합된 단일 밴드 형태로 발전되고 있다. 이러한 통합형 스마트 밴드는 병원 밖에서도 환자가 능동적으로 상처를 관리할 수 있는 자가 치료 플랫폼을 제공한다.
본 논문에서는 기술의 근간이 되는 상처 회복의 원리부터 생물학적 파라미터(parameter) 및 모니터링 센서의 종류, 치료 전략, 생체 적합 디자인, 임상적 효용성에 이르기까지 스마트 밴드 시스템의 전반적인 내용을 아우르며 기술의 한계점 및 발전 방향성을 제시한다.
2. 상처 치유 메커니즘
상처 치유는 지혈(hemostasis), 염증(inflammation), 증식(proliferation), 리모델링(remodeling)의 네 가지 주요 단계를 따라 진행되는 생물학적 재생 과정으로, 단계 간 순차적인 상호작용을 통해 진행된다(Fig. 1(a)) [1-4]. 과정은 피부의 구조와 기능을 복원하기 위한 일련의 세포 및 분자 기전으로 구성되며, 각 단계에서는 서로 다른 세포 유형과 생리활성 인자들이 긴밀하게 조율된다.
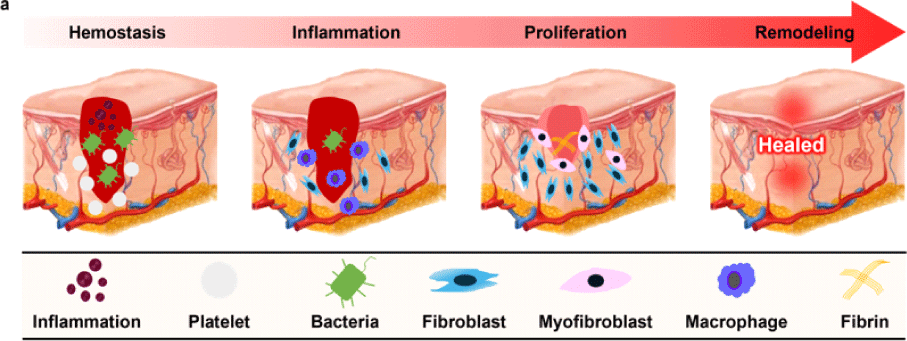
상처 발생 직후에는 손상된 혈관에서 출혈이 일어나며 지혈 단계가 시작된다. 혈소판은 손상 부위로 빠르게 모여들어 피브린(fibrin) 기반의 혈전(thrombus)을 형성하여 출혈을 억제하고, 감염(infection)에 대한 1차 방어막을 제공함과 동시에 혈소판은 혈관 수축을 유도하고 platelet-derived growth factor(PDGF) 등의 성장 인자(growth factor, GF)를 분비하여 다음 단계를 유도한다.
지혈 후 수 시간 내에는 염증 반응이 개시되며, 이 단계에서는 호중구(neutrophil)가 먼저 도달하여 세균(bacteria)과 이물질, 괴사된 조직을 제거하는 초기 방어가 진행된다. 이어 대식세포(macrophage)가 활성화되어 손상 조직을 정리하고, epidermal growth factor (EGF), vascular endothelial growth factor(VEGF), fibroblast growth factor(FGF) 등의 GF를 분비하여 조직 재생을 유도한다. 대식세포는 환경에 따라 M1형(염증 유도)에서 M2형(재생 유도)으로 전환되며, 염증 해소와 재생을 조절한다. 염증 반응은 치유과정에 필수적이지만 과도하거나 장기화될 경우 만성염증으로 악화될 우려가 있다.
증식 단계는 일반적으로 상처 발생 수일 후부터 시작되며, 조직 복원의 핵심 과정이다. 섬유아세포(fibroblast)는 콜라겐(collagen)과 세포외기질(extracellular matrix, ECM)을 생성해 상처 부위를 메우고, 혈관내피세포(endothelial cell)는 혈관신생(angiogenesis)을 통해 산소와 영양 공급 과정을 회복시킨다. 각질형성세포(keratinocyte)는 상처 가장자리에서 이동하여 상피화(epithelialization)를 유도하고, 육아조직(granulation tissue)은 임시 지지체 역할을 한다.
리모델링 단계는 수주에서 수개월간 지속되며, 초기에 형성된 임시 지지 구조 역할을 하던 콜라겐 III가 콜라겐 I로 전환되어 조직이 강하게 재구성되도록 돕는다. 근섬유아세포(myofibroblast)의 수축 작용에 따라 상처 크기가 감소하게 되고, 조직의 강도와 탄력이 점차 정상 피부 수준으로 회복된다.
3. 상처 부위 모니터링을 위한 유연센서
상처 치유 과정에서는 다양한 생리적 변화가 동반되며, 이러한 변화를 실시간으로 감지하고 분석할 수 있는 시스템은 정확한 진단과 치료에 필수적이다. 온도, pH, 습도 등의 생리적 지표(biomarker)는 염증 반응, 감염 여부, 혈류 공급 및 조직 재생 상태를 반영하며, 이들의 변화는 상처의 치유 단계를 객관적으로 평가할 수 있는 근거를 제공한다[5].
최근 이러한 지표들을 정밀하게 감지하기 위한 유연 단일소자 센서들이 개발되었으며, 피부에 밀착되어 상처 부위의 생리적 변화를 지속적으로 모니터링함으로써 감염 여부나 회복 속도를 보다 정확하게 판단하는 데 도움을 준다. 본 절에서는 스마트 밴드시스템에서 핵심적으로 활용되는 온도, pH, 습도 센서의 구조, 작동 원리 및 특성에 대해 소개한다.
상처 부위의 온도는 염증 및 감염 유무를 판단하는 데 있어 유용한 지표 중 하나이다. 염증 반응이 유도되면 해당 부위의 혈류량 증가로 인해 국소적으로 체온이 상승한다. 이러한 미세 온도 변화를 정밀하게 감지하기 위해 피부에 밀착 가능한 초박형 유연 전자기기인 표피 전자 시스템(epidermal electronics system, EES)이 개발되었다[6,7]. EES에 내장된 온도 센서는 금속(구리) 미세 패턴으로 이루어진 저항체를 기반으로 하며, 온도 변화에 따라 금속의 전기 저항이 달라지는 원리를 이용해 피부 표면의 온도를 정밀하게 측정한다. 센서 내부의 미세 금속 패턴은 4-포인트 프로브(four-point probe) 방식과 적외선(infrared, IR) 카메라 및 핫플레이트(hotplate)를 이용한 캘리브레이션(calibration)을 통해 저항 변화를 정확하게 감지한다. 수술 후 회복 기간 동안 상처 주변에 부착된 EES는 상용 적외선 카메라와 유사한 수준의 체온 변화를 감지하였다. 수술 3일차부터 상처 부위의 온도가 급격히 상승하였고, 이는 염증 반응이 본격적으로 시작되었음을 의미한다(Fig. 2(a)). EES 내부에 위치한 6개의 온도 센서 어레이는 모니터링 신뢰성 및 장기간 작동 안정성을 시사한다(Fig. 2(b)). 또한, 약 22.1 kPa의 낮은 탄성 계수(Young's modulus)를 갖는 초박형 고분자 기판 위에 센서가 구성되어 피부에 밀착된 형태로 움직임이나 굴곡에 의한 영향을 최소화한다. 실제로, 이 온도 센서는 기계적 신장(최대 15%)이나 굽힘(곡률 반경 15~45 mm)과 같은 물리적 변형에도 온도 측정값이 거의 변하지 않음이 실험적으로 입증되었다. 예를 들어, 센서를 15%까지 신장시켰을 때 저항 변화는 0.025%에 불과하며, 이로 인한 온도 측정값 변화는 0.05℃ 이내로 매우 작다. 또한, 다양한 곡률 반경으로 굽혔을 때도 온도 변화는 0.01℃ 이하로 나타나, 일상적인 피부 변형이나 움직임에 의한 영향이 거의 없음을 보여준다(Fig. 2(c)). 이와 같은 웨어러블(wearable) 형태의 유연 온도 센서는 환부의 효과적인 모니터링이 가능해 스마트 드레싱 시스템의 핵심 요소로 주목받고 있다.
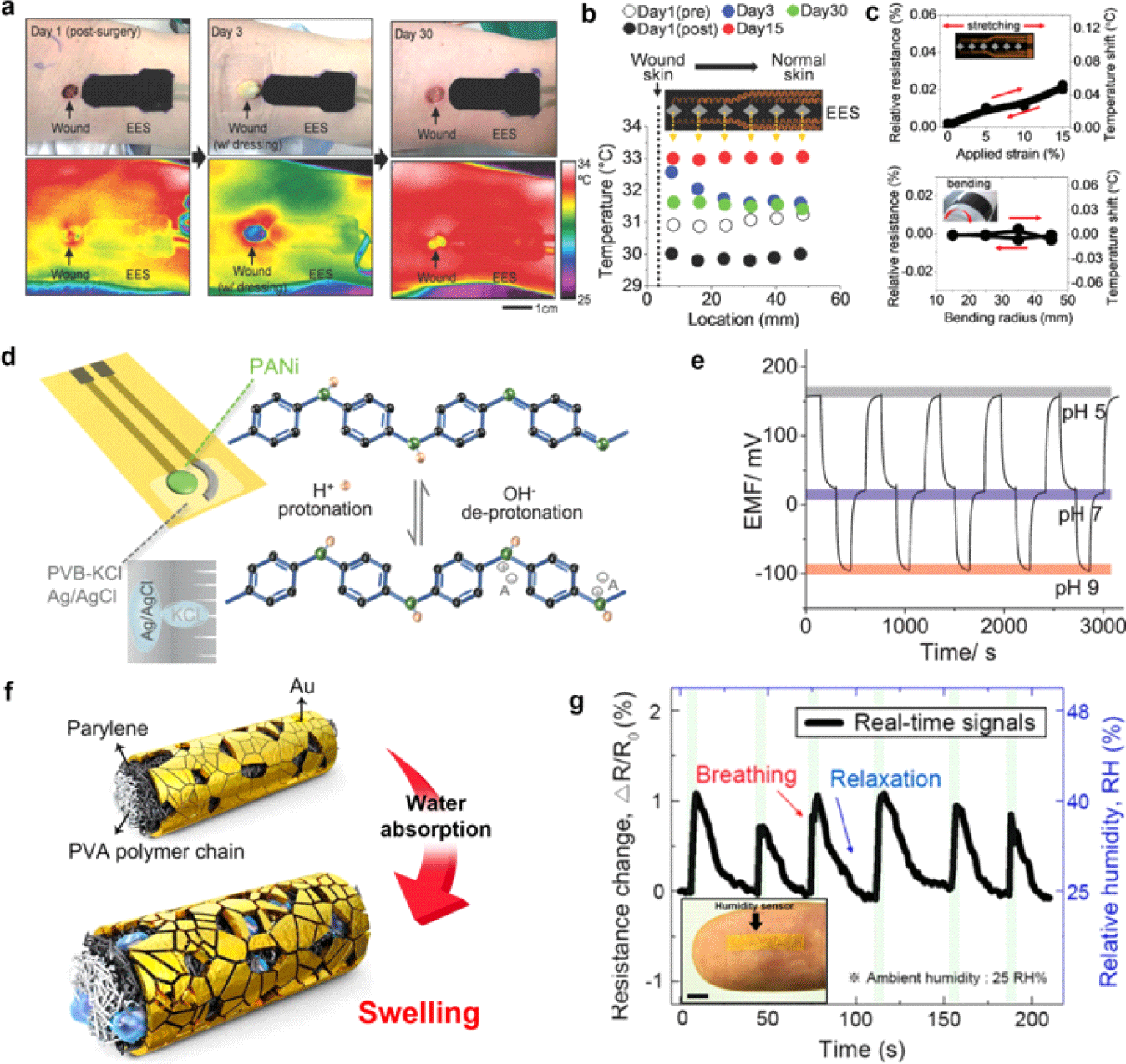
상처의 pH는 치유 단계 및 감염 유무를 반영하는 또 다른 중요한 생리학적 지표이다. 일반적으로 건강한 피부는 약산성(pH 4~6)의 환경을 유지하지만, 감염이 발생하면 상처 환경은 중성 또는 알칼리성으로 변화한다[7-9]. 이러한 pH 변화를 정밀하게 감지하기 위해 유연한 레이저 유도 그래핀(laser-induced graphene, LIG) 전극 위에 전도성 고분자(conductive polymer)인 폴리아닐린(polyaniline, PANi)을 코팅한 전고체형 pH 센서가 개발되었다(Fig. 2(d))[10]. PANi는 수소 이온 농도에 따라 양성자화(protonation) 또는 탈양성자화(deprotonation)되어 전기화학적 특성이 변화한다. 산성 환경에서는 양성자화가 일어나 PANi가 전도성을 가지는 상태(emeraldine salt)로 존재하고, 염기성 환경에서는 탈양성자화로 인해 비전도성 상태(emeraldine base)로 전환된다. 이로 인한 전도성 변화는 작동 전극과 기준 전극 사이의 전위차(electromotive force, EMF)로 측정되며, 이를 통해 상처 부위의 pH를 실시간으로 정량 분석할 수 있다. 해당 pH 센서를 pH 5 → 7 → 9 → 5 순서로 반복적으로 전환된 용액에 노출시켰을 때, 각 pH 환경에 따라 EMF가 빠르고 정확하게 변하는 것이 확인되었다(Fig. 2(e)). 이는 센서가 우수한 민감도와 가역성(reversibility)을 바탕으로 상처 환경의 산성화 또는 알칼리화 상태를 정밀하게 감지할 수 있음을 보여준다.
습도는 상처 부위의 수분 상태를 반영하는 중요한 생리학적 지표로, 과도한 건조(dry) 또는 습윤(wet) 환경은 치유를 지연시킬 수 있다. 따라서 적절한 치유 환경 유지를 위해 상처 부위의 습도를 실시간으로 감지하는 기술이 요구되며, 이를 위해 구조적 변형을 기반으로 작동하는 유연 습도 센서가 개발되었다[11]. 이 센서는 친수성 고분자인 폴리비닐알코올(poly(vinyl alcohol), PVA) 나노섬유(nanofiber) 위에 내구성 보호막으로써 패럴린(parylene C)을 증착하고, 그 위에 전도성 금(Au) 박막을 얇게 코팅한 삼중 나노메쉬(nanomesh) 구조로 구성되어 있다. 고습도 환경에서는 PVA가 수분을 흡수해 팽창하면서 섬유 직경이 증가하고, 이로 인해 금 박막 내 입자 간 거리가 벌어지며 전도 경로(conduction pathway)가 불연속적으로 단절되어 센서의 저항이 증가하는 원리로 작동한다(Fig. 2(f)). 손가락에 부착된 습도 센서를 통해 반복적인 호흡 자극에 따라 센서의 저항이 실시간으로 변화하는 모습을 볼 수 있으며(Fig. 2(g)), 이는 센서가 수분 변화에 민감하게 반응함을 보여준다. 이처럼 유연하고 밀착 가능한 구조를 갖춘 습도 센서는 신체 움직임이나 곡면 부착에도 안정적으로 작동하며, 생리학적 습도 변화를 정밀하게 추적할 수 있어 스마트 드레싱 시스템에 효과적으로 통합될 수 있다.
이외에도 산소농도[12,13], 효소 활성[14,15], 임피던스 변화[16,17] 등 다양한 생리적 지표를 감지할 수 있는 센서들에 대한 연구가 활발히 진행 중이다. 본문에서 언급한 주요 생리적 지표별 센서의 특성들을 정리하였다(Table 1). 보다 정밀한 진단을 위해서는 상처 환경에 특이적인 새로운 생리적 지표의 발굴과 동시에, 여러 신호를 동시에 감지할 수 있는 통합 센서 기술이 요구된다. 최근에는 pH, 포도당, 온도, 변형 등을 동시에 측정할 수 있는 실 기반 센서(thread-based sensor) 플랫폼도 보고되고 있으며[18], 이러한 기술은 스마트 밴드의 임상적 유용성을 더욱 확장시킬 수 있을 것으로 기대된다.
| Biomarker | Sensing mechanism | Duration time | Clinical significance | Ref |
|---|---|---|---|---|
| Temperature | Resistive | 30 days | Sensitive detection of local inflammation and infection | [7] |
| pH | Potentiometric | 12 h (in vitro) | Early indication of infection and healing stage shifts | [10] |
| Humidity | Resistive | Few minutes to hours (point of care) | Real-time assessment of optimal wound moisture level | [11] |
| Oxygen | Optical | 48 h | Direct monitoring of tissue oxygenation and perfusion | [12] |
| Electrochemical | 1 h | Continuous monitoring of wound oxygenation in chronic wounds. | [13] | |
| Enzyme | Electrochemical |
5 days (in vivo, mouse) 5 weeks (clinical, patients) |
Wireless, real-time wound biomarker monitoring for personalized care. | [14] |
| Colorimetric | 20−30 s (point of care) | Rapid identification of elevated protease activity | [15] | |
| Impedance | Bioimpedance | 142 h | Non-invasive tracking of tissue recovery and integrity | [16] |
| Impedance spectroscopy | 3 days | Early, noninvasive detection and mapping of tissue damage before visual signs | [17] |
4. 상처 치유 가속화를 위한 치료 전략
상처 치유는 복잡한 생리학적 과정을 수반하며, 이를 촉진하기 위한 다양한 치료법이 활발히 연구되고 있다. 대표적으로 전기자극 치료(electrotherapy)[19-21], 광자극 치료(phototherapy)[22-24], 열자극 치료(thermotherapy)[25], 약물 전달(drug delivery)[26-28] 등이 있으며, 각 방법은 고유의 작용 메커니즘을 바탕으로 상처 재생을 가속화한다(Table 2). 본 절에서는 상처 치유 가속화를 위한 전기/광자극 기반 웨어러블 치료 시스템에 대해 집중적으로 살펴보고자 한다.
| Stimulation type | Stimulus parameter | Power source | Clinical significance | Duration time | Ref |
|---|---|---|---|---|---|
| Electrical | 250 mV/mm, 500 mV/mm, 1,000 mV/mm, 250 ms, 2 Hz | PGM | Cellular growth, proliferation, migration | 14 days | [19] |
| 54 mA, 25−560 μs, 1 Hz | Rechargeable neuromuscular stimulator | Oxygenation, blood circulation, release of vascular endothelial growth factor | 4 weeks | [20] | |
| Photonic | 630 nm, 10 mW/cm2(rLED), 470 nm, 50 mW/cm2(bLED) | r&bLED | Increased granulation tissue, promotion of collagen deposition, neovascularization | 8 days | [22] |
| 632 nm, 11.1/22.2 mW/cm2 | rLED | Collagen synthesis, angiogenesis | 14 days | [23] | |
| 630 nm, 15.05 mW/cm2 | rLED | Cellular proliferation, tissue synthesis | 10 days | [24] | |
| Thermal | 32°C | Graphene heater | Vasodilation, increasing supply of oxygen and nutrients for healing | 14 days | [25] |
| Drug delivery | Cationic drug [methylene blue(MB)] | Zn-MoS2 hybrid supercapacitor,4V | Cellular proliferation, suppression of inflammation | 5 min.−1 h | [26] |
| Quercetin (QC) | pH/ROS-responsive scaffold | Promotion of collagen deposition, tissue remodeling, alleviated wound inflammation | 2-3 days | [27] | |
| VEGF | ROS-responsive Gel EFM (hexapeptide Glu-Phe-Met-Phe-Met-Glu) | Cellular proliferation, angiogenesis, alleviated inflammation | 72 h | [28] |
전기자극 치료는 손상된 조직에서 형성되는 내인성 전기장(endogenous electric field, EEF)을 모사하거나 증폭하는 방식으로 세포 행동을 조절하여 조직 재생을 유도하는 기술이다. 피부 손상 시 발생하는 전위 차이에 의해 형성된 EEF는 섬유아세포, 각질형성세포, 면역세포 등의 이동, 증식, 분화(differentiation)를 매개하며 상처 치유 과정 전반에 중요한 생리학적 신호로 작용한다. 이에 따라 외인성 전기자극(exogenous electrical stimulation)을 가하여 EEF를 인위적으로 생성하거나 증폭함으로써 치유 반응을 촉진하는 전략이 주목받고 있다. 기존의 고전압 기반 전기자극기는 화상 위험성, 부피 및 전력 소모 문제 등으로 인해 실제 임상 적용에 제약이 존재한다. 이를 극복하기 위한 방안으로 저강도 펄스(pulse) 전기자극을 적용한 웨어러블 전기자극 치료 시스템이 제안되고 있다[19-21].
이러한 배경에서 B. B. Mandal 연구진은 실크 피브린 기반의 나노입자 이온겔(silk fibroin silver(Ag) nanoparticles ionogels, SAIG)을 활용한 전자 드레싱(electrical bandage, e-bandage) 시스템을 구현하였다 [19]. 해당 시스템은 전기자극 패치, 신호 전달을 위한 이온겔, 펄스 생성 모듈로 구성되며, 생체 모델에서 상처 치유 촉진 효과가 확인되었다(Fig. 3(a), Fig. 3(b)). 토끼 전층(full-thickness wound) 상처 모델에 단일 방향의 펄스 자극(250 ms, 2 Hz)을 하루 2시간씩 총 14일간 적용하였고, 전기장 강도는 250 mV/mm(ES1), 500 mV/mm(ES2), 1,000 mV/mm(ES3)의 세 가지 조건으로 설정되었다. 비교군으로는 무처리군(untreated, UNT) 과 전기자극 없이 SAIG만 적용한 군이 포함되었으며, 실험 7일차 기준 상처 면적 비교 결과 ES2 조건에서 가장 뚜렷한 상처 수축 효과가 관찰되었으며, 중간 강도의 전기장이 세포의 이동과 증식, 혈관 신생을 효과적으로 촉진한 결과로 해석된다(Fig. 3(c)). 반면, 고강도 자극 조건(ES3)에서는 오히려 치유 속도가 둔화되는 양상이 나타났는데, 이는 과도한 자극이 조직에 스트레스를 유발했을 가능성을 시사한다. 이러한 결과는 저강도 펄스 전기자극 기반의 웨어러블 시스템이 생체 조직 재생을 효과적으로 유도할 수 있음을 보여주며, 동물 모델에서의 유효성 입증을 통해 임상적 활용 가능성을 뒷받침한다.
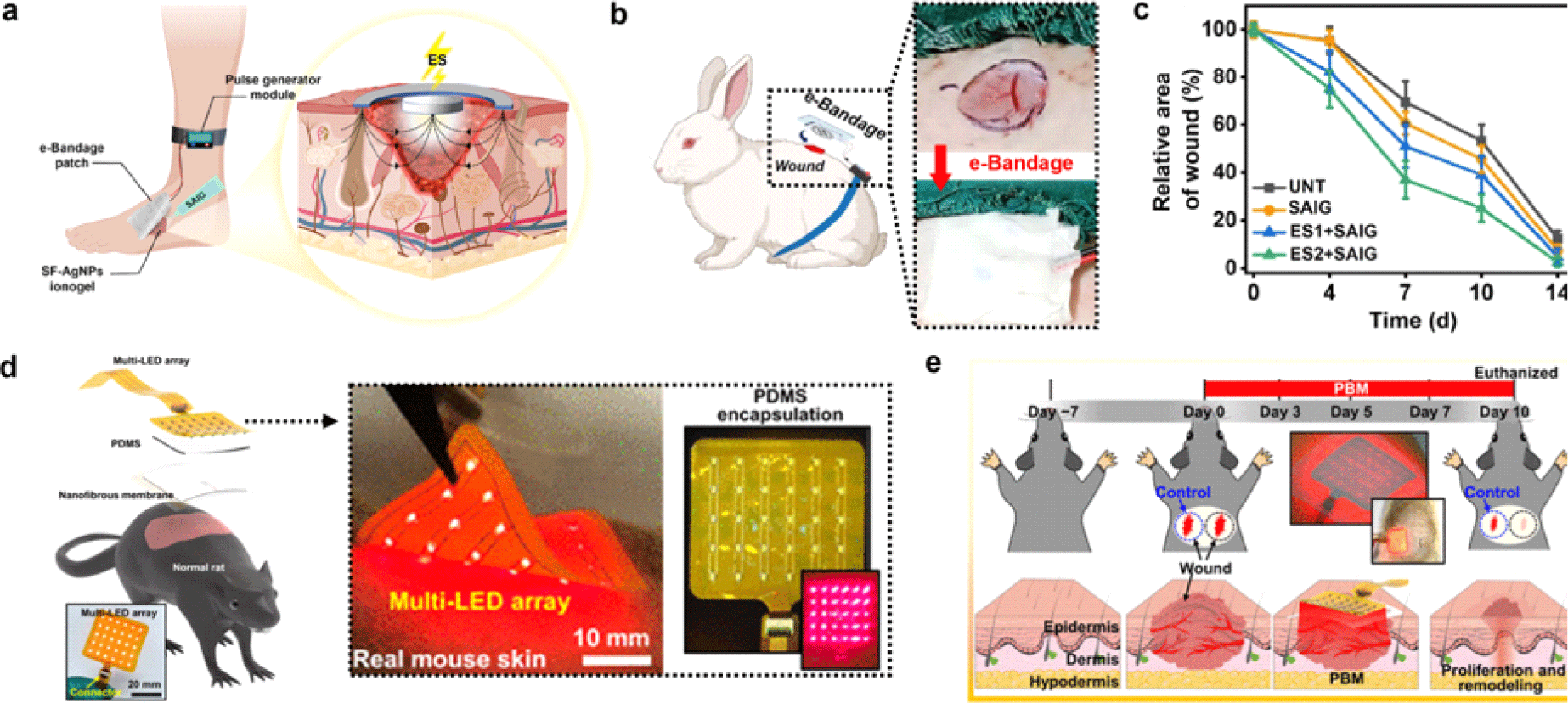
특정 파장의 빛은 세포 수준에서 대사 조절, 염증 억제, 혈류 촉진 등의 생물학적 반응을 유도하여 조직 재생을 위한 광자극 치료에 효과적으로 활용되고 있다. 특히, 저강도 근적외선(near infrared, NIR) 영역 빛을 이용한 광자극 치료(photobiomodulation)는 adenosine triphosphate(ATP) 생산을 촉진하고 활성산소 생성을 억제하는 동시에 섬유아세포 증식을 유도함으로써 조직 재생을 가속화할 수 있는 비침습적(non-invasive) 치료법으로 주목받고 있다. 그러나 상처 부위의 불규칙한 표면은 균일한 광자극 전달을 어렵게 하여 치료 효율 저하를 초래할 수 있다. 이러한 기술적 한계를 극복하기 위해 다양한 전략이 제시되고 있으며, 다음 문단에서는 그중 유연 광소자와 생체모사형 드레싱 구조를 통합한 광자극 치료 기반 웨어러블 시스템을 소개하고자 한다[24].
해당 패치는 도파민이 도입된 히알루론산(dopamine-modified hyaluronic acid, D-HA)과 젤라틴(gelatin, Gel) 기반의 나노섬유 멤브레인(membrane)을 중심으로 설계되었다(Fig. 3(d))[24]. 이는 ECM의 3차원 구조를 모사하여 세포 부착과 조직 재구성을 유도하며, 높은 수분 유지력과 생체적합성을 바탕으로 초기 상처 환경을 안정화시킨다. 멤브레인 상단에는 630 nm 파장의 NIR 빛을 방출하는 다중 LED 배열이 탑재되어 있으며, 이는 투명한 폴리디메틸실록산(polydimethylsiloxane, PDMS) 소재로 보호되어 외부 이물질 침투를 차단하고 전자소자의 내구성을 확보한다. 유연한 폴리이미드(polyimide, PI) 기판 위에 집적된 LED는 상처의 복잡한 형상에도 밀착이 가능하다. 방출된 630 nm NIR 빛은 진피(dermis)까지 도달하여 ATP 생성 경로를 활성화하고, 섬유아세포의 증식을 촉진하는 등 상처 재생에 최적화된 광생물학적 자극을 유도한다. 치료 효과 검증을 위해 연구진은 전층 상처를 유도한 쥐 피부 모델에 D-HA/Gel 멤브레인과 유연 LED 패치를 적용하여 반복적인 광자극 실험을 수행하였다(Fig. 3(e)). 그 결과, 멤브레인과 광자극을 병행한 군에서 유의미한 상처 수축 및 흉터 억제 효과가 확인되었으며, 기존 드레싱 대비 더 빠른 조직 재생과 우수한 기계적 복원력을 보였다. 특히, 도파민 기반 멤브레인의 높은 조직 접착력과 광자극에 의한 생물학적 반응이 시너지 효과를 발휘하여 염증 반응 없이 안정적인 상처 회복이 가능함을 입증하였다.
5. 스마트밴드 시스템의 통합 전략, 다기능성, 디자인
스마트 밴드 시스템은 앞서 제시된 센서를 통한 상처 모니터링과 다양한 자극 혹은 약물 전달 기반의 치료법을 단일 시스템 안에 집적할 수 있는 전략이 필요하다. 실제로, 상처의 상태를 확인할 수 있는 모니터링 시스템과 상태에 따른 치료를 제공하는 치료 시스템을 통합한 스마트 밴드 시스템은 상처 치료의 효율성을 극대화하기 위한 목적으로 활발히 연구가 진행되고 있다[29,30]. 본 절에서는 상처 모니터링 및 치료에 필요한 무선 스마트 플랫폼의 통합 전략, 다기능성, 생체 적합 소재 및 디자인을 중심으로 해당 플랫폼의 작동 원리를 보여준다.
이전 절에서 중점적으로 다룬 치료법이 적용된 스마트 밴드 시스템으로 무선 상처 모니터링 및 상처 치료 스마트 밴드[30] 시스템과 optical-electrical synergistic patch(OESP)[31] 시스템이 있다. Fig. 4(a)는 상처의 상태를 실시간으로 모니터링하고, 동시에 전기적 자극과 약물 전달 기반의 치료를 제공하는 다기능 플랫폼으로 설계되었다. 구체적으로, 시스템이 두 개의 주요 구성 단위(Unit I, Unit II)로 구성되어 있으며, 각각 다층 구조로 통합되어 있다. Unit I은 모니터링 및 치료 목적의 피부 밀착 일회용 모듈이며, Unit II는 데이터 송수신 목적의 탈부착 가능한 독립형 제어 모듈이다. 두 모듈은 자석을 이용한 결합 구조를 통해 손쉽게 연결 및 분리가 가능하며, 직관적인 '플러그 앤 플레이(plug-and-play)' 작동이 가능하도록 설계되었다. 이러한 시스템의 도입은 치료 기간 동안 고감도의 모니터링, 자동화된 치료, 편리한 교체 방식을 제공함으로써 치료 효율을 극대화할 수 있다.
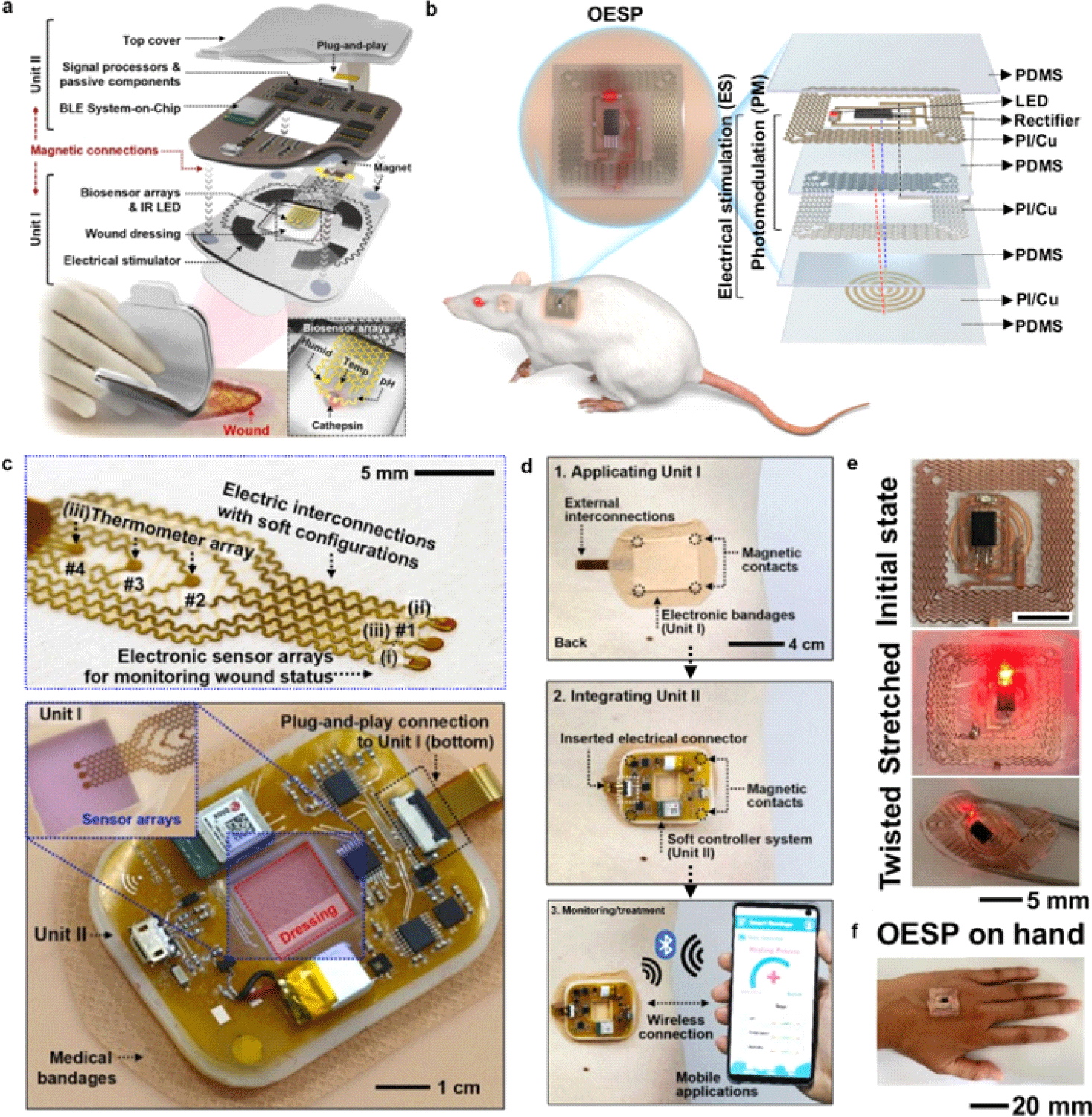
Fig. 4(b)는 전기적 자극에서 더 나아가 광자극치료법까지 적용된 사례로, 전기자극 수행층에 더해 광자극 수행층 역시 지니고 있으며, 무선 전송을 위한 송/수신기 층을 갖는다. 광자극(LED, 620 nm) 및 전기자극 구성 요소는 마이크로 정류기를 통해 이중층 무선 회로에 연결된 무선 전송 및 전극 층에 차례로 설치되었다[32].
스마트 밴드 시스템이 다양한 기능을 가질수록 상처에 대한 여러 가지 대응이 가능하다. 그러나, 기능이 많다는 것은 시스템 자체의 고밀도화를 필연적으로 수반하기 때문에 상처에 부착되는 디바이스 측면에서 적절한 기능을 지닌 시스템을 구현하는 전략이 필요하다.
Fig. 4(c)에 나타난 시스템의 다기능성에 대해 살펴보면, Unit I은 염증 관련 생리적 지표인 카텝신(cathepsin)과 습도, pH, 온도와 같은 생리학적 지표를 감지하는 바이오센서 어레이((i) 습도 센서(hygrometer), (ii) pH 센서(pH meter), (iii) 온도 센서(thermometer))로 구성되어 있다(Fig. 4(c)). 여기에 상처가 낫는 과정에서 생성되는 카텝신과 반응하여 약물을 제공하는 하이드로겔층과 줄어든 하이드로겔 부피를 광학적으로 측정하여 전기적 자극을 제공하는 평면 전극이 통합되어 있다. Unit II는 데이터 수집, 시스템 제어, 무선 통신 기능을 담당한다. 해당 스마트 밴드 시스템 사용 과정에서 스마트폰 기반 사용자 인터페이스와 연동되어 지속적이고 실시간 건강 상태 모니터링을 가능하게 한다. 이러한 기능은 환자 스스로의 자가진단뿐만 아니라, 의료진의 원격 모니터링 시스템과도 효과적으로 연계될 수 있다(Fig. 4(d)). 두 번째 시스템에서는 상처 부위를 전기적으로 자극할 수 있는 전기자극 시스템과 상처 치유 과정에서 세포 성장에 도움을 줄 수 있는 광자극 시스템 그리고 자극 시스템이 운용될 수 있도록 에너지를 송수신하는 무선 전송 시스템을 갖는다는 것을 확인할 수 있다. 첫 번째 시스템과는 달리 모듈형이 아닌 일체형 시스템으로써 보다 많은 기능을 지니기보다는 치료 목적에 초점을 맞추어 시스템을 구현한 것을 알 수 있다. 이러한 모듈형 시스템과 일체형 시스템 사이의 차이를 바탕으로 기능에 대한 실현 가능성 혹은 집적 가능성을 판단하는 것이 시스템 제작에 있어 중요하다.
스마트 밴드 시스템은 단순한 수동적 보호재의 기능을 넘어서, 복합적이고 능동적인 치료 플랫폼으로 확장되고 있다. 생체 신호 모니터링 기능을 통해 온도, pH와 함께 포도당(glucose)[33], 요산(uric acid) [34], 세균[35] 등 다양한 생화학적 지표를 정량 분석할 수 있으며, 이를 기반으로 감염 상태 및 치유 과정을 실시간으로 평가한다. 치료 기능으로는 자극 반응형 약물 방출 시스템[36], 전기자극 기반 조직 재생 유도[31], 광[32] 치료 등이 적용되며, 이들은 감지된 생체 신호에 따라 자동으로 작동하는 폐루프(closed-loop)형 제어 구조를 형성한다. 무선 통신 기술은 사용자 또는 의료진과의 실시간 정보 교환을 가능케 하며, 일부 시스템은 마찰전기 발전기(triboelectric nanogenerator)와 같은 자가 발전 기술을 통합하여 독립적 에너지 구동이 가능하도록 설계되고 있다[37].
설계 측면에서 스마트 밴드 시스템은 기계적 유연성, 생체 적합성, 사용자 편의성을 동시에 충족해야 한다. 기판 소재로는 PDMS, 폴리우레탄, 실크 피브로인 등 유연하고 통기성이 우수한 생체 재료가 주로 사용되며, 이는 장기간 피부 접촉 시 자극을 최소화하고 상처 부위의 통기성을 확보하는 데 기여한다.
첫 번째 시스템에서는 밴드가 붙어있는 상태에서 상처 부위를 육안으로 확인할 수 있다는 장점을 갖는다. 또한, plug-and-play 방식으로 디자인하여 소모적인 치료 시스템 부분만 교체할 수 있으며, 유연한 부착 물질을 사용함으로써 기존 밴드의 접착력에 대한 기대감을 충족시켰다(Fig. 4(c)).
두 번째 시스템은 굴곡이 많은 인체 부위에 맞춰 회로의 변형률에 대한 내성을 높여 설계되었다. 구불구불한(serpentine) 패턴은 인장 및 비틀림 변형 시 발생하는 국소 응력을 효과적으로 분산시켜, 반복적인 움직임에도 손상 없이 안정적인 작동을 가능하게 한다. 이러한 기계적 유연성은 OESP의 초기 상태, 즉 변형되지 않은 평면 상태(Fig. 4(e))에서 시작해 실제 변형된 상태까지의 실험 결과로 확인할 수 있으며, 상부 이미지는 인장(tensile) 변형을, 하부 이미지는 비틀림(torsional) 하에서의 구조적 안정성을 각각 시각적으로 보여준다.
마지막으로 Fig. 4(f)는 시스템을 실제 사람 손등에 부착된 모습을 보여주는 일러스트를 통해 인체 적용 가능성과 착용 상태를 보여준다. 이는 사용자 경험과 실용성 측면에서도 우수한 결과를 보여주는 사례이다.
6. 통합형 치료 스마트 밴드의 전임상 평가(In vivo)
하나의 유연한 시스템 내에 상처 상태를 실시간으로 감지하고 동시에 치료 자극을 제공할 수 있는 통합형 치료 플랫폼이 제안되면서, 실제 생체 환경에서의 적용 가능성에 대한 검증도 활발히 이루어지고 있다[31, 38]. 본 절에서는 In vivo기반 상처 부위의 생리학적 지표 모니터링 및 맞춤형 치료를 통해 상처 치유 효능을 평가한 결과를 소개하고자 한다.
무선 상처 모니터링 및 상처 치료 스마트 밴드 시스템을 평가하기 위해 동물 모델(쥐) 등 부위에 직경 10 mm의 피부 전층 결손 상처를 만들어 Unit I을 상처 부위에 부착하여 Unit II를 결합하여 측정되었다(Fig. 5(a))[30]. 상처 부위에서의 생리학적 지표인 습도, pH, 온도 등의 변화를 실시간으로 모니터링하는 것은 상처 치유 과정을 정량적으로 평가하고, 그 경과를 보다 정밀하게 추적할 수 있는 중요한 수단으로 주목받고 있다(Fig. 5(b))[31]. In vivo 결과, 습도의 경우 상처 부위에서 분비되는 삼출물(exudate)의 영향으로 인해 초기 단계에서 급격한 상승을 보이며, 이후 염증 반응이 완화되고 조직 재생이 진행됨에 따라 점차 정상 범위로 감소하는 양상을 나타내었다. pH 역시 상처의 노출된 조직과 간질액의 유출로 인해 초기에 pH 7.4 수준까지 상승하나, 시간이 지남에 따라 건강한 피부의 정상 수준인 약 pH 5.5 내외로 점차 회복되는 경향이 관찰되었다. 상처 부위의 온도는 초기에는 정상 피부보다 높은 36.5℃ 이상이었으나, 시간이 지남에 따라 점차 36.5℃ 이하로 감소하였다.
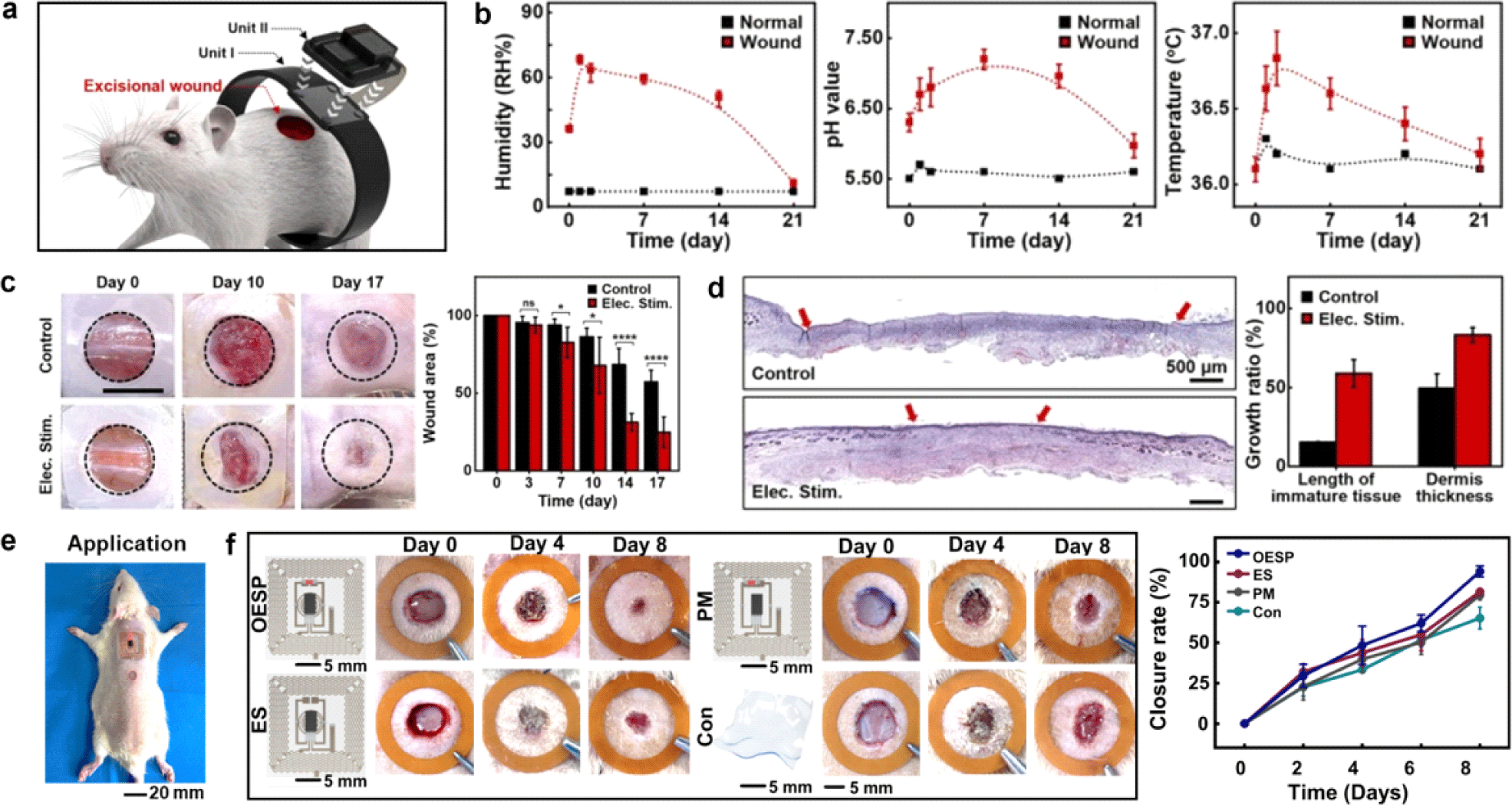
상처 부위를 모니터링함과 동시에, 치유를 촉진하기 위한 수단으로 전기자극을 적용한 결과, 치료 효과가 뚜렷하게 나타났다. 구체적으로는 2.5 V, 1 kHz의 전기자극을 17일간 지속적으로 가한 실험에서, 전기자극을 받은 군은 대조군에 비해 월등히 빠른 치유 속도를 보였으며, 특히 10일 이후부터 상처 폐쇄 속도의 차이가 현저하게 나타났다. 전기 자극군의 상처 폐쇄율은 75±9.8%에 달하였다(Fig. 5(c)). 조직학적 분석(H&E염색 및 k10 면역 염색)을 통해서도 재상피화(re-epithelialization) 길이와 진피 두께의 회복이 확인되었으며(Fig. 5(d)) 각질형성세포의 분포를 통해 자극군에서 상처 조직의 재형성이 더 활발하게 진행되었음을 확인할 수 있었다. 또한 자극군에서 염증 환경 지표인 카텝신 L과 B 수치가 감소하였으며 이는 전기 자극이 염증의 반응을 억제하여 재형성의 단계로 유도되었음을 입증한다. 따라서 전기 자극이 조직 재생 및 재구성을 촉진함으로써 회복 기간 동안 부작용 없이 상처가 치유될 수 있음을 시사한다.
이와 관련하여, 복합 자극의 효용성을 In vivo 수준에서 입증한 연구에서(Fig. 5(e), Fig. 5(f))[32] SD 랫트(Sprague-Dawley rat)의 등 부위에 직경 1 cm의 피부 전층 결손 상처를 만들어 평가하였다. 전기 자극과 광자극을 동시에 적용한 OESP군이 단독 자극 군보다 현저히 높은 상처 치유 효과를 나타냈다. OESP군의 상처 폐쇄율은 실험 초기부터 빠른 회복 양상을 보였으며, 8일 후에는 평균 94% 이상의 상처 폐쇄율을 기록하여 전기자극 및 광자극군 뿐만 아니라 대조군과도 뚜렷한 차이를 나타냈다(Fig. 5(e)). 이러한 결과는 두 자극을 동시에 적용한 것이 각각의 치료 기전인 세포 이동 및 증식, 염증 조절, 조직 재형성을 상호 보완적으로 증강시켜 보다 효과적인 조직 재생 환경을 조성함을 의미한다.
즉, 제안된 통합형 치료 스마트 밴드는 실제 생체 환경에서도 상처 상태를 정밀하게 모니터링하고 동시에 치료 자극을 제공함으로써 상처 치유의 효율성과 정밀성을 향상시킬 수 있음을 전임상 평가를 통해 입증하였다. 특히 전기자극과 광자극의 복합 적용은 각각의 치료 효과보다 증폭시켜 빠르고 안정적인 조직 재생을 유도하는 핵심 전략으로 작용하였다.
7. 결론 및 전망
본 논문에서는 상처 부위의 생체 신호(온도, pH, 습도)를 유연 센서를 통해 실시간으로 모니터링하고, 이를 바탕으로 치료 조건을 조절할 수 있는 스마트 밴드 시스템에 대해 고찰하였다. 상처 환경은 시간에 따라 동적으로 변화하며, 치료 자극 역시 그에 맞춰 정밀하게 조절되어야 한다. 기존의 치료 방식은 이러한 변화에 수동적으로 대응할 수밖에 없었으나, 생체신호 감지와 치료 기능이 통합된 스마트 밴드는 상처 상태에 최적화된 치료를 가능하게 한다. 특히, 만성 상처, 당뇨병성 궤양(diabetic ulcer), 수술 후 감염 관리 등과 같이 정밀한 치료가 요구되는 고위험군 환자에 있어 본 시스템은 효과적인 대안이 될 수 있다. 나아가 향후 연구에서는 다음과 같은 방향으로 기술의 고도화가 요구된다. 첫째, 다양한 생체지표를 정밀하게 감지하기 위해 센서 간 신호 간섭을 최소화하는 설계와 신뢰성 높은 측정을 위한 기술 개발이 병행되어야 한다. 둘째, 폐루프형 시스템을 복잡한 생체 환경에서도 안정적으로 구현하기 위해 센서-처리-자극 간 실시간 연동 구조를 확보하고, 지연 시간을 최소화하는 기술이 필요하다. 셋째, 다양한 인체 부위에 밀착 가능하면서도 장시간 사용에 적합한 고신축성 및 기계적 내구성을 갖춘 소재 개발과 함께, 사용자 불편을 줄이기 위한 인체공학적 디자인 설계가 요구된다. 이러한 기술적 기반이 갖추어질 때, 스마트 밴드는 단순한 치료 보조 수단을 넘어 생체신호 기반의 맞춤형 치료 플랫폼으로 진화할 수 있다. 특히, 저전력 무선 통신 기술과 자가 구동 전원 시스템[39] 등의 요소가 결합되면서, 해당 시스템은 향후 디지털 헬스케어 및 원격 의료 분야에서 핵심적인 역할을 수행할 것으로 기대된다.